Krumme Membranen machen Proteine attraktiv
Forschungsbericht (importiert) 2007 - Max-Planck-Institut für Polymerforschung
Leben in einer Seifenblase
Alle lebenden Zellen auf unserer Erde sind von einer Lipidmembran umgeben. Diese grenzt sie von ihrer äußeren Umgebung ab, erlaubt aber gleichzeitig einen kontrollierten Stoff- und Energietransport, damit – in Einklang mit dem zweiten Hauptsatz der Thermodynamik – Ordnung im Inneren erzeugt und aufrechterhalten werden kann. Das Bauprinzip dieser Membranen ist bestechend einfach: Sie bestehen aus amphiphilen Lipidmolekülen, die eine wasserlösliche Kopfgruppe mit zwei wasserunlöslichen Kohlenwasserstoffketten vereinen. In Wasser aggregieren Lipide werden deshalb ganz von selbst zu zweidimensionalen Schichten, in denen die unlöslichen Ketten durch die Kopfgruppen vom Wasser abgeschirmt werden, so wie schematisch in Abbildung 1 skizziert. Diese Schichten können geschlossene „Vesikel“ bilden, sozusagen Seifenblasen unter Wasser, die rudimentärsten Anfänge einer Zellwand. Weil dies spontan geschieht, entfällt nicht nur ein großer Kontrollaufwand, die entstandenen Membranen sind auch stabil gegen lokalisierte „Verletzungen“. Was sich spontan bildet kann sich auch spontan reparieren!
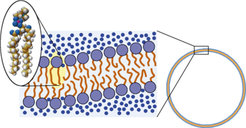
Zellmembranen mögen einst so einfach begonnen haben – heute sind sie hochkomplexe Gebilde, bestehend aus hunderten von Lipidsorten und tausenden eingebetteten Proteinen. Sie übernehmen unzählige Aufgaben, angefangen vom kontrollierten Stofftransport bis hin zur Proteinsortierung und Signalweiterleitung. Ihr grundsätzlicher Aufbau aber hat sich nicht verändert. Und genau wie zu Anbeginn des Lebens sind auch heute noch bestimmte physikalische Aspekte der Lipidmembran – wie etwa die Fähigkeit zur Selbstaggregation oder ihre elastischen Eigenschaften – von größter biologischer Bedeutung.
Wie Membranen Kräfte transportieren
In der Abteilung Theorie des MPI für Polymerforschung wird in der Untergruppe von Markus Deserno die Biophysik von Zellmembranen mit theoretischen und computergestützten Ansätzen erforscht. Dabei geht es insbesondere um die Frage, welche Konsequenzen die Wechselwirkung der Membran mit Proteinen auf einer Längenskala hat, die größer ist als die Proteine selber. Wenn sich ein Protein an eine Membran bindet oder in sie einbettet, dann verändert es dadurch lokal bestimmte physikalische Eigenschaften der Membran. Dazu gehören zum Beispiel die Ordnung der Lipide, deren molekulare Zusammensetzung, die Dicke der Membran, ihre Fluktuationen oder ihr lokaler Krümmungszustand. Diese Veränderungen breiten sich um das Protein herum in der Membran aus und sind auch noch in einiger Entfernung vom Protein spürbar. Insbesondere können sie von anderen Proteinen „gespürt“ werden und auf diesem Wege dazu führen, dass sich die Proteine z.B. anziehen oder abstoßen. Solche membranvermittelten physikalischen Wechselwirkungen ergänzen deshalb spezifisch biologische Protein-Protein-Bindungen. Die Verteilung und Aggregation von Proteinen auf einer Membran, wie sie für deren Funktion so wichtig ist, ergibt sich damit als ein Wechselspiel zwischen diesen biophysikalischen und biochemischen Prozessen.
Einfache Physik, schwierige Gleichungen
In Desernos Gruppe wurde insbesondere die Art von Wechselwirkung betrachtet, die durch die Krümmung der Lipidmembran vermittelt wird. Der Effekt, dass gebogene Oberflächen Kräfte transportieren können, ist aus dem Alltagsleben gut bekannt: Zwei auf Milch schwimmende Cornflakes ziehen sich über die Kapillarkräfte der verzerrten Milchoberfläche an. Zwei auf einer Matratze liegende Personen „ziehen sich an“, weil jeder in die vom jeweils anderen gebildete Mulde rollt. Tatsächlich wird sogar Gravitation selber seit Einstein als eine Wechselwirkung verstanden, die auf einer von Massen bewirkten Krümmung der Raumzeit beruht. In all diesen Fällen ist es die gekrümmte Geometrie der Milchoberfläche, der Matratze oder der Raumzeit, die für die Wechselwirkung verantwortlich ist, und stets ist deshalb Differentialgeometrie das mathematische Werkzeug der Wahl um diese Phänomene zu beschreiben. Das trifft folglich auch auf die Kräfte zu, die durch gekrümmte Membranen induziert werden. Unglücklicherweise jedoch sind die aus einer solchen geometrischen Theorie resultierenden „Feldgleichungen’’ nichtlinear. Dies ist für den Theoretiker sehr unangenehm, weil dann eine ganze Reihe an vertrauten Techniken nicht mehr funktioniert – angefangen mit dem so selbstverständlich anmutenden „Superpositionsprinzip“, dass nämlich die von zwei Objekten bewirkte Verformung einfach die Summe der jeweils einzelnen Verformungen ist. In der Tat ist diese Nichtlinearität genau der Grund, warum die Einstein'sche Gravitationstheorie um so vieles mühsamer ist als die Newton'sche. Da aus demselben Grund die Gleichungen für Membranen im Allgemeinen nicht analytisch gelöst werden können (außer für den Fall schwacher Verformungen, in dem sie sich mit guter Näherung linearisieren lassen), ist es deshalb nicht leicht, ihren grundsätzlichen Charakter zu ergründen.
Anziehung oder Abstoßung?
Es gibt allerdings einen komplementären Zugang zu dem Problem, der das Lösen komplizierter Feldgleichungen vermeidet. Der Trick besteht im Rückgriff auf den Membran-Spannungstensor. Er schafft einen direkten Zusammenhang zwischen den Kräften und der Membrangeometrie, und seine koordinatenfreie Beschreibung wurde vor wenigen Jahren von Capovilla und Guven vorgestellt [1]. In Zusammenarbeit mit Guven ist es in der Deserno-Gruppe gelungen, membranvermittelte Wechselwirkungen analytisch exakt mit der Membrangeometrie in Beziehung zu setzen [2, 3] (siehe Abb. 2). Dabei stellte sich heraus, dass selbst so elementare Fragen wie „Werden sich die Proteine anziehen oder abstoßen?“ nicht allgemein beantwortet werden können. Auch hier kommt man letztlich um das Lösen der Gleichungen nicht herum, wenn man quantitative Resultate anstrebt; aber der Zugang erlaubt ob seiner geometrischen Unmittelbarkeit einen ungetrübteren Blick auf die Physik, der einem nicht von Anfang an durch eine wie auch immer gewählte Parametrisierung der Membranoberfläche in potenziell komplizierten Koordinaten vernebelt wird.
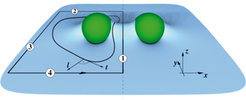
Diese Erkenntnis, dass die Richtung der Kraft zwischen zwei Proteinen keine offenkundige Angelegenheit ist, war wichtig, weil über den Punkt des „Vorzeichens“ dieser Kraft Verwirrung bestand: Einerseits gab es Experimente, die sowohl in zellbiologischen Systemen [4] als auch in kolloidalen Modellsystemen [5] eine Anziehung zwischen den der Membran anhaftenden Objekten nahelegten. Andererseits zeigten approximative linearisierte Rechnungen, dass im komplett symmetrischen Fall eine Abstoßung vorliegen sollte [6]. Da sowohl Experimente als auch Rechnungen nur unter bestimmten Vereinfachungen durchgeführt und interpretiert werden konnten, konnte diese Frage zunächst nicht geklärt werden.
Impressionistische Lipide auf dem Computer
In der Deserno-Gruppe wurde diese Frage deshalb auch von einer ganz anderen Seite her beleuchtet, nämlich mittels Computersimulationen – jenem Werkzeug, das seit etlichen Jahrzehnten aus der physikalischen Forschung nicht mehr wegzudenken ist. Im vorliegenden Fall ist aber zu beachten, dass es selbst mit den heute verfügbaren Höchstleistungsrechnern immer noch unmöglich ist, einen genügend großen Ausschnitt einer Membran zusammen mit den interessierenden Proteinen detailgetreu im Computer abzubilden und sein zeitliches Verhalten zu verfolgen. Stattdessen haben Deserno und seine Mitarbeiter ein stark vergröbertes Modell entwickelt, in dem Lipide durch lediglich drei zusammengeheftete Kugeln repräsentiert werden, während auf das umgebende Wasser komplett verzichtet wird [7], siehe Abbildung 3.
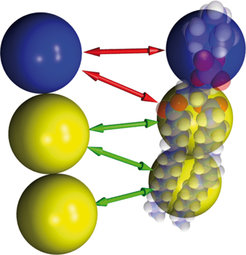
Die membrankrümmenden Proteine wurden dementsprechend ebenfalls nur durch gebogene Scheibchen bestehend aus etwa 100 ähnlichen Kugeln dargestellt. Was auf den ersten Blick gewagt aussieht ist in Wahrheit durchaus quantitativ: Es lässt sich nämlich vorab verifizieren, dass dieses Modell auf den relevanten großen Längenskalen die hier wesentlichen Eigenschaften einer Membran korrekt wiedergibt [7 - 9]. Man mag hier an ein impressionistisches Gemälde denken, das von Weitem betrachtet durchaus den richtigen Seh-Eindruck vermittelt, trotz des bei näherem Blick frappanten Mangels an Detail.
In solchen vergröberten Simulationen fanden Deserno und Mitarbeiter, dass sich membrankrümmende Proteine tatsächlich anziehen können. Mehr noch, wenn eine genügend große Anzahl solcher Proteine zur Verfügung steht, können diese alle gemeinsam zu einem großen Aggregat zusammenfinden [10]. Da dieses jedoch aus lauter vorgekrümmten Untereinheiten besteht, ist es nicht einfach flach in die Membran eingebettet, sondern induziert eine Ausstülpung; eine kleine Blase, die an der ansonsten immer noch flachen Membran hängt (siehe Abb. 4).
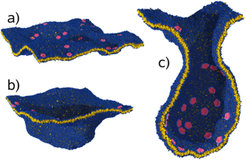
Damit ist nicht nur geklärt, dass die Membran tatsächlich durch ihre Krümmung attraktive Wechselwirkungen zwischen Poteinen induzieren kann; die Simulationen legen darüber hinaus auch einen Mechanismus nahe, mit dem an Zellmembranen unter Mitwirkung von Proteinen Vesikel entstehen können. Diese Vesikel sind für das Funktionieren jeder Zelle von eminenter Wichtigkeit, da sie z.B. für den kontrollierten Transport von in ihnen eingeschlossenen Substanzen benötigt werden. Es ist faszinierend zu sehen, dass ganz elementare und unspezifische physikalische Prozesse zu ihrer Bildung führen können. Doch damit stellt sich um so vehementer die Frage, mit welchen spezifischen biologischen Kontrollmechanismen die Zelle dafür sorgt, dass Vesikelbildung genau dann und dort passiert, wo es genetisch kodierte Notwendigkeiten gebieten – ein Problem, dass wohl nur in Zusammenarbeit zwischen Biologen und Biophysikern gelöst werden wird.



