„Good Vibrations“ – Molekülen bei der Arbeit zusehen
Forschungsbericht (importiert) 2011 - Max-Planck-Institut für Polymerforschung
In vielen verschiedenen Wissenschafts- und Forschungsbereichen ist die Charakterisierung der molekularen Zusammensetzung von sowohl der Masse als auch der Oberfläche von komplexen Systemen mit Hilfe von nicht-invasiven Verfahren mit hohem räumlichen und zeitlichen Auflösungsvermögen außerordentlich wichtig. Die Disziplinen, in denen solche Charakterisierungsmethoden von Vorteil sind, reichen von der Zellbiologie („Wie funktioniert die Zellmembran und welche Rolle spielt das Wasser an der Grenzfläche?“) bis hin zur heterogenen Katalyse („Wie adsorbieren und wechselwirken Moleküle und wie desorbieren Reaktionsprodukte?“). Auch was das Thema Molekülstrukturen von Materialien angeht, gilt es nach wie vor, viele ungeklärte Fragen zu beantworten.
Einer jener Stoffe, über die zwar schon umfangreiche Nachforschungen angestellt wurden und die uns dennoch weiterhin zahlreiche Rätsel aufgeben, ist das Wasser. Die besondere Herausforderung liegt in der Beschaffung von Informationen über die molekulare Zusammensetzung, die molekulare Konformation der verschiedenen Bestandteile und deren Dynamik und Ausrichtung an einer Grenzfläche. Bei Oberflächen und Grenzflächen ergibt sich das besondere Problem, die Informationen von den Grenzflächen von denen aus dem Volumen zu trennen: Es gestaltet sich oft schwierig, diese dünnen Molekülschichten der Oberfläche einzeln „zu betrachten“.
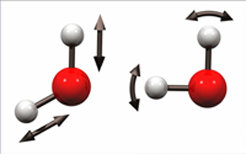
Die Lösung für all diese Probleme liegt in den Molekülen selbst verborgen: Die chemischen Bindungen, die die einzelnen Atome in einem Molekül miteinander verbinden, verhalten sich wie winzige Federn, die die Moleküle zum Schwingen bringen. Diese molekularen Schwingungen sind beispielhaft für Wasser in Abbildung 1 gezeigt. Die beiden Wasserstoffatome können sich relativ zum Sauerstoffatom bewegen und strecken (s. linke Abbildung, OH-Streckschwingung). Gleichzeitig können sie sich auch zueinander bewegen (s. rechte Abbildung, OH-Beugeschwingung). In größeren Molekülen gibt es eine Vielfalt von Schwingungen, die für die verschiedenen Teile des Moleküls charakteristisch sind. Zudem hängt die genaue Frequenz der Schwingungen von der direkten Umgebung der Moleküle ab. Wenn es also gelingt, die Schwingungseigenschaften der Moleküle zu bestimmen, können funktionelle Gruppen analysiert und deren unmittelbare Umgebung bestimmt werden. Dies ist die Basis der Schwingungsspektroskopie, welche Infrarotlicht benutzt, um molekulare Schwingungen zu untersuchen.
Konventionelle Infrarotspektroskopie
Die Infrarotspektroskopie macht sich die Tatsache zunutze, dass Molekülschwingungen oft Licht einer speziellen, für ihre Struktur charakteristischen Frequenz im Infrarotbereich absorbieren. Diese Absorptionen sind resonante Frequenzen, das heißt, dass die Frequenz des absorbierten Infrarotlichtes zu der Frequenz der schwingenden Bindung oder Gruppe korrespondiert. Die Energien werden dabei durch die Stärke der chemischen Bindung („die Federkonstante“) und die Masse der beteiligten Atome bestimmt. In der konventionellen Infrarotspektroskopie benutzt man den mittleren Infrarot-bereich, der von zirka 4000 bis 400 cm−1 (2,5 – 25,0 μm) reicht, um die grundlegenden Schwingungen sowie die damit verbundene Rotations-Schwingungs-Struktur zu untersuchen.
Die konventionelle Infrarotspektroskopie wurde in der Vergangenheit aufgrund ihrer einfachen Durchführbarkeit und des relativ hohen Informationsgehalts gerne als Analyseverfahren in einer Vielzahl von Disziplinen eingesetzt. In den meisten Chemielaboren ist es nach wie vor das Standard-Spektroskopieverfahren. Dennoch hat auch die konventionelle Infrarotspektroskopie einige Nachteile, insbesondere sind die zeitliche und räumliche Auflösung beschränkt. Zudem ist es schwierig, mit dieser Methode spezifische Informationen über Oberflächen zu gewinnen: Obgleich bereits Methoden entwickelt wurden, mit denen man ausschließlich die äußersten Mikrometer eines Materials untersuchen kann, so entspricht dies trotzdem noch Tausenden von Molekülen. Die eigentliche Oberflächenregion eines Materials ist jedoch typischerweise nur wenige Moleküle dick.
Die konventionelle Infrarotspektroskopie zählt zu den sogenannten linearen Spektroskopieverfahren. Das bedeutet, dass die Systemantwort (in dem Fall die Absorption des Infrarotlichts) sich linear zur Intensität des eingestrahlten Lichtes verhält. Mit der Einführung von ultrakurzen Laserimpulsen gewann dann schließlich die nicht-lineare Spektroskopie an Bedeutung. Durch die hohe Intensität der angewandten Lichtimpulse können nicht-lineare Prozesse, wie beispielsweise die Erzeugung neuer Lichtfarbtöne, induziert werden. Dies wiederum schafft neue Möglichkeiten für die Molekularspektroskopie. Zwei dieser Prozesse werden im Folgenden aufgegriffen: Die nicht-lineare optische Spektroskopie zweiter Ordnung, die das Schwingungsspektrum von ausgewählten äußersten Molekularschichten eines Grundmaterials liefert, und die Spektroskopie dritter Ordnung, welche es ermöglicht, die Schwingungsspektroskopie mit beispiellos hoher räumlicher Auflösung durchzuführen.
Nicht-lineare optische Spektroskopie zweiter Ordnung: Der Blick auf die Oberfläche
Wenn ein intensiver Infrarotimpuls mit einem Laserimpuls aus dem sichtbaren Spektralbereich kombiniert wird und beide auf eine Oberfläche gerichtet werden, kann ein neuer Lichtfarbton aus der Summe der beiden Frequenzen der eingestrahlten Lichtstrahlen entstehen. Dieser Prozess wird Summenfrequenzerzeugung (sum frequency generation – SFG) genannt und in Abbildung 2 erläutert. Wenn das Infrarotlicht mit einer Schwingung an der Oberfläche resonant ist, fördert dies den SFG-Prozess. Zudem kann das SFG-Licht nur in der Oberflächenregion erzeugt werden, weil die Symmetrie der Moleküle dort gestört ist. Für Wasser heißt das, dass wir das Schwingungsspektrum der äußersten Schicht der Wassermoleküle aufnehmen können. Dies wird im mittleren Bild der Abbildung 2 dargestellt.
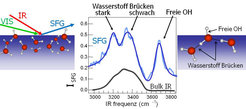
Ebenfalls in Abbildung 2 ersichtlich ist, dass das SFG-Spektrum der Wasseroberfläche sich deutlich vom Infrarotspektrum aus dem Volumen eines Wasserkörpers unterscheidet: Das SFG-Spektrum weist drei Spitzen auf, von denen eine auf die freie OH-Gruppe zurückgeht, die aus der Oberfläche herausragt; die anderen beiden sind den OH-Gruppen an der Oberfläche zuzuordnen, die durch Wasserstoffbrücken mit anderen Wassermolekülen verbunden sind. Somit ermöglicht diese Technik einen Einblick in die molekularen Grenzflächenstrukturen. Diese sind für die Elektrochemie, die Membranbiophysik und die atmosphärische Chemie besonders aufschlussreich. Das Verfahren ist jedoch nicht auf die Untersuchung von Wasser beschränkt. Es wurde auch bereits für die Charakterisierung molekularer Adsorbate in (Modell-) Katalysatorsystemen genutzt.
Nicht-lineare optische Spektroskopie dritter Ordnung: Schwingungsmikroskopie
Ein wesentlicher Nachteil der Infrarotspektroskopie ist die fehlende Möglichkeit, das Licht aufgrund des langwelligen Infrarotlichts in kleinen Volumina zu fokussieren. Außerdem ist die Detektion der Infrarotabsorption unter solchen Bedingungen äußerst kompliziert. Daher sind die Möglichkeiten der Infrarotmikroskopie sehr beschränkt. Ersetzt man das Infrarotlicht nun durch zwei sichtbare Lichtstrahlen, deren Frequenzunterschied zu dem der Schwingung passt, kann man Schwingungsmikroskopie mit einem besseren räumlichen Auflösungsvermögen als bei der konventionellen optischen Mikroskopie betreiben. Dieses Verfahren wird als CARS-Mikroskopie (Coherent Anti-Stokes Raman Scattering) bezeichnet. Der große Vorteil der CARS-Mikroskopie besteht darin, dass das Kontrastmittel durch die spezifischen Schwingungen der Moleküle selbst gestellt wird. Gleichzeitig ist die Empfindlichkeit bei sichtbarem Licht sehr hoch, da die eigentliche Detektion auch bei sichtbarem Licht erfolgt.
Die Besonderheit der CARS-Mikroskopie liegt in der Kombination ihrer verschiedenen Eigenschaften: Das Verfahren bedarf keiner zusätzlichen (fluoreszierenden) Kontrastmittel, es ist ein nicht-invasives Verfahren (so können beispielsweise auch lebende Zellen abgebildet werden) und bedarf außerdem keiner besonderen Präparation der Proben. Zudem liegt das räumliche Auflösungsvermögen dieser Methode im Submikron-Bereich (für gewöhnlich zwischen 300 und 400 Nanometer), es bietet damit 3D-Abbildungsmöglichkeiten, kann chemische Komponenten im Bereich eines zehntel bis hundertstel Mikrometers innerhalb von Millisekunden erkennen und ermöglicht somit 3D-Bilder in brauchbarer Qualität [4].
Ein Beispiel aus der Zellbiologie soll im Folgenden den breiten Anwendungsbereich der CARS-Methode verdeutlichen. Außerdem können in der Katalyse [5, 7] und bei den Mikroreaktoren [8] mit dieser Methode gute Ergebnisse erzielt werden. In diesen Experimenten untersuchten wir Zellen mit einem hohen Lipidanteil. Dies ermöglichte die Darstellung der Bildung von Lipidtropfen, wie bereits auf der Weißlichtaufnahme dieser Zellen in Abbildung 3 sichtbar ist. Lipidtropfen sind wichtige Zellorganellen, die für zahlreiche Funktionen, wie zum Beispiel die geregelte Einspeicherung und Absonderung von Fettsäuren, zuständig sind. Diese Lipidtropfen sind nachweislich an der Entwicklung wichtiger metabolischer Krankheiten wie Fettleibigkeit, Diabetes Mellitus und Arteriosklerose beteiligt.
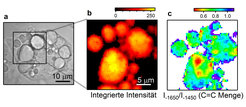
Die Zusammensetzung der Lipidtropfen spielt eine wichtige Rolle: Gesättigte Fettsäuren – wie sie in tierischen Fetten enthalten sind – gelten als nicht so gesund wie pflanzliche Fette. Der Unterschied liegt im Grad der Sättigung, die chemisch von der Anzahl an ungesättigten C=C-Bindungen in den Fetten abhängt. Obgleich der Sättigungsgrad in Lipidtropfen, die aus Zellen und Geweben isoliert wurden, bereits eingehend untersucht wurde, fehlen quantitative Informationen über die Heterogenität in Lipidanordnungen einzelner Tropfen und mögliche Variationen innerhalb der einzelnen Lipidtropfen. Daher sind quantitative Methoden, welche auf die Schwingungen der Lipide reagieren – insbesondere auf die C=C-Bindungsdichte – für die Abbildung von Lipidtropfen in lebenden Zellen, aber auch Modellsystemen [9], bestens geeignet. Bei Zellen, die mit einer Mischung aus gesättigten und ungesättigten Fettsäuren angereichert wurden, sind die Lipide sehr ungleich auf die Lipidtropfen verteilt. Dies wird anhand der Verteilung der C=C-Dichte in Abbildung 3c deutlich. Solche Erkenntnisse sind für die Entwicklung neuer Medikamente und Wirkstoffe gegen die oben genannten Krankheiten hilfreich.
Hochentwickelte, auf Lasern basierende Molekularspektroskopie wie in den oben genannten Beispielen gibt Aufschluss über Bewegung, Reaktion und Interaktion von Molekülen in einer großen Vielfalt von Systemen. Ein weiterer entscheidender Vorteil solcher Methoden, der bisher nicht zur Sprache kam, ist das extrem hohe zeitliche Auflösungsvermögen im Bereich von Femtosekunden (ca. 10-15 s), das mit diesen Verfahren aufgrund der verwendeten ultrakurzen Laserimpulse erreicht werden kann. Dank dieser Technik können wir Schwingungsspektren mit hohem zeitlichem Auflösungsvermögen aufzeichnen und so den Molekülen „bei der Arbeit zusehen“.


