Nanodiamanten mit Gitterdefekten als innovative Materialien für biomedizinische Anwendungen
Forschungsbericht (importiert) 2017 - Max-Planck-Institut für Polymerforschung
Die Herstellung von kleinsten Diamantpartikeln, sogenannten Nanodiamanten, mit räumlich präzise platzierten Gitterdefekten und einer kontrollierten Morphologie stellt eine große Herausforderung dar. Die synthetischen Anstrengungen sind jedoch sehr lohnend. Funktionalisierte Nanodiamanten versprechen, als Quantensensoren einen einzigartigen Einblick in die Struktur und Dynamik von einzelnen Biomolekülen in ihrer zellulären Umgebung zu liefern und als effiziente Therapeutika und verbesserte Kontrastmittel einen effizienten und nachvollziehbaren Transport von Wirkstoffen in vivo zu ermöglichen.
Unser organisches Leben basiert auf dem Element Kohlenstoff, das in der Natur in ganz unterschiedlichen Formen vorkommt. Die kugelförmigen Fullerene, das extrem flache Graphen oder dreidimensionale Graphit- und Diamantstrukturen finden vielfältigste industrielle Anwendungen. Wir beschäftigen uns insbesondere mit dem Material Diamant. Dieses wird unter extremen Bedingungen wie hohen Drücken und Temperaturen, wie sie im Erdinneren vorherrschen, gebildet und besitzt zahlreiche herausragende Eigenschaften, wie beispielsweise die höchste Wärmeleitfähigkeit aller bekannten Materialien und die größte Härte aller natürlichen Stoffe. Im Diamanten sind die Kohlenstoffatome tetraedrisch gebunden und die chemischen Bindungen liegen vollständig in sp3-Hybridisierung vor. Ein perfekter Diamant-Kristall ist somit für sichtbares Licht aufgrund der großen optischen Bandlücke von 5,48 Elektronvolt (dies entspricht einer Wellenlänge von 226 Nanometern) transparent.
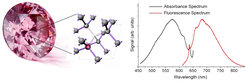
Als Funktionsmaterial hat Diamant allerdings über lange Zeit ein Schattendasein gefristet, da er sich nur schwer chemisch modifizieren lässt. Dies hat sich erst in jüngster Zeit verändert, seit man in der Lage ist, die Perfektion des Kristallgitters von Diamanten aktiv durch das Einfügen von atomaren Defekten zu durchbrechen. Besondere Eigenschaften wie Farbe und Magnetismus, entstehen durch Substitutions- und Fehlstellendefekte in der Diamantgitterstruktur, die sichtbares Licht absorbieren und emittieren können. Ein wichtiger Defekt ist das sogenannte Stickstoff-Fehlstellen- oder auch NV-Zentrum. Dies ist ein Punktdefekt, der aus einem Substitutionsstickstoffatom besteht, das sich direkt neben einer Gitterfehlstelle befindet und entlang der [111]-Richtung im Diamantkristall orientiert ist. Daraus resultiert eine spinabhängige Fotolumineszenz, die den Zugang zu einer optisch auslesbaren Diamant-Quantensensorik eröffnet. Diese Technologie besitzt das große Potenzial der Detektion einzelner Moleküle mit atomarer Auflösung bei Raumtemperatur und verspricht, das lange gehegte Ziel der Einzelmoleküldetektion mit atomarer Auflösung bei Raumtemperatur zu realisieren. Man kann sich vorstellen, dass winzig kleine Diamant-Quantensensoren mit präzise platzierten und stabilen NV-Defektstellen als Magnetfeldsensoren an Proteine andocken und so wichtige Erkenntnisse für das Verständnis von Biomolekülen in ihrer natürlichen, zellulären Umgebung übermitteln sowie tiefe Einblicke in grundlegende biologische Phänomene liefern könnten. Dass dies nicht mehr nur Science Fiction ist, konnten wir im Rahmen der Detektion von Ferritin (ein Eisenspeicherprotein) über magnetisches Rauschen als Kontrastmechanismus erstmals mit unseren Kooperationspartnern Fedor Jelezko und Martin Plenio (Universität Ulm) demonstrieren [1]. Dieses wird durch das paramagnetische Eisen im Inneren des Ferritin-Proteinkäfigs induziert und konnte mit einer Empfindlichkeit im Bereich der Einzelmoleküldetektion realisiert werden. Daraus ergibt sich die Vision, Diamant-Quantensensoren für die direkte Bestimmung des Eisengehalts im Blut auf der Einzelproteinebene zu entwickeln.
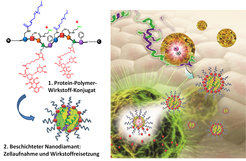
Möchte man mit Diamant-Quantensensoren Ziele im Inneren von lebenden Zellen ansteuern, so müssen diese funktionalisiert werden, um die nötige Stabilität und zelluläre Spezifität zu realisieren. Hierbei gelang es uns, durch die Beschichtung mit Protein-Copolymeren sehr stabile und verträgliche Nanodiamanten herzustellen, die sich mit vielfältigen Funktionalitäten wie DNA, biologischen Erkennungsstrukturen oder Wirkstoffen ausstatten lassen, so dass sie an zelluläre Strukturen binden und in Zellen aufgenommen werden können [4,5]. Wir konnten zeigen, dass beschichtete NV-Nanodiamanten in das Innere von lebenden Zellen eindringen, cytosolisch freigesetzt werden und sogar in der Lage sind, Wirkstoffe wie das gängige Krebsmedikament Doxorubicin in Krebszellen zu transportieren [3].
Aufgrund der facettenreichen Eigenschaften sollen sich Diamantnanopartikel als inerte Träger in der Krebsmedizin etablieren. Sie vereinen attraktive Detektionsmöglichkeiten mittels Fluoreszenz oder Hyperpolarisation [1]. Diese Attribute lassen von einer höchst empfindlichen Detektion von Tumorgewebe bis zu einzelnen Tumorzellen und einem online verfolgbaren Transport von Wirkstoffen in das Tumorgewebe träumen. In ersten Studien mit Brustkrebs-Xenotransplantaten konnten wir in Kooperation mit der Gruppe von Thomas Simmet (Universität Ulm) eine signifikante Verkleinerung der Tumore nach Behandlung mit den Nanodiamant-Wirkstoffkonjugaten nachweisen [3].
Das breite Forschungsfeld der Diamant-Quantensensorik hat vielfältige Herausforderungen zu meistern, darunter unter anderem die Präparation geeigneter Materialien. Bislang existiert kein synthetischer Zugang zu Diamanten mit präzise positionierten Gitterdefekten ausgehend von molekularen Verbindungen. Vielmehr kommen Hochdruck-Hochtemperatur-Wachstum oder die chemische Gasabscheidung, Beschuss mit hochenergetischen Partikeln, sowie aufwändige Mahlverfahren und oxidative Oberflächenmodifikationen zum Einsatz. Diese liefern mehr oder weniger geeignetes und reproduzierbares Material. Wir arbeiten daran, die bislang gängigen, material- und zeitaufwändigen, undefinierten Herstellungsverfahren abzulösen. Dafür werden molekular definierte Kristallisationskeime hergestellt, die die gewünschten Defektstellen aufweisen mit dem Ziel, diese in das Diamant-Kristallgitter einzubauen. Wenn es gelingt, diese präparativen Schwierigkeiten zu meistern, eröffnen sich einzigartige Möglichkeiten, nicht-invasive Nanosensoren herzustellen und zu dirigieren, um kleinste Magnetfelder und Elektronenspins in vitro und schließlich auch in vivo in lebenden Zellen zu ermitteln. Damit ließen sich künftig einzigartige Einblicke in die Strukturen und biologischen Reaktionen in lebenden Organismen gewinnen.
Literaturhinweise
Nano Letters 16, 10, 6236-6244 (2016)
Angewandte Chemie International Edition 55, 23, 6586-6598 (2016)
Advanced Functional Materials 25, 42, 6576–6585 (2015)
Journal of the American Chemical Society 137, 31, 9776–9779 (2015)
Nano Letters 13, 7, 3305-3309 (2013)

