Wie Nerven wachsen können
Forschungsbericht (importiert) 2019 - Max-Planck-Institut für Polymerforschung
Haben Sie schon einmal versucht, einen Stift ohne Ihren Daumen zu halten? Dann werden Sie festgestellt haben, wie schwierig dies ist. Was zunächst wie eine nette Fingerübung klingt, ist für manch einen bittere Realität: Verletzte und durchtrennte Nervenbahnen infolge von Autounfällen oder bestimmten Berufsunfällen lassen Glieder oder ganze Körperteile oft unbeweglich werden. Die einzige Chance, die Funktionalität wieder herzustellen, war bisher eine Operation: Bei einigen Operationen werden dazu Nervenstränge an einer anderen Körperstelle entnommen und an der durchtrennten Stelle eingefügt. So können die Nervenenden wieder zusammenwachsen und das Körperteil wird wieder beweglich.
Wachstum braucht Struktur
In unserer Forschung versuchen wir, geschädigte Nerven durch ein von uns entwickeltes Material aus körpereigenen Bausteinen zum Wachsen zu bewegen. Denn: Nerven sind durchaus in der Lage, eine durchtrennte Stelle wieder selbst zu überbrücken. Bei Verletzungen wird jedoch neben der Nervenbahn selbst auch oft das Gerüst, welches diese Bahnen trägt, zerstört. Diese sogenannte extrazelluläre Matrix bildet den Haftgrund für Nervenbahnen – ähnlich wie Tomatenpflanzen ein Rankgitter benötigen, benötigen Nervenzellen diese Matrix, um daran entlangzuwachsen. Chemisch gesehen besteht die Matrix aus speziellen Arten von Proteinen, langen Molekülketten, die wie ein Wollknäuel zusammengefaltet sind. Viele dieser winzig kleinen Wollknäuel lagern sich nebeneinander an und formen lange Fasern. Ein Gewirr aus verschiedenen Fasern bildet dann wiederum die extrazelluläre Matrix, an denen sich die Nervenzellen festhalten können.
Fasern aus dem Legobaukasten
Damit sich solche Fasern bilden, finden im Körper viele komplexe biomolekulare Prozesse statt. Um diese künstlich im Reagenzglas nachzubilden, sind sie jedoch zu komplex. Daher gehen wir in unserer Forschung einen etwas anderen Weg: Wir verwenden die gleichen Grundmaterialien, setzen sie jedoch anders zusammen. Hierbei nutzen wir kurze Molekülketten, sogenannte Peptide, die aus den gleichen körpereigenen Bausteinen wie Proteine bestehen. Diese Peptide stellen wir chemisch gezielt her, sodass sich die Position jedes einzelnen Bausteins genau festgelegen lässt. Im übertragenen Sinne erzeugen wir auf diese Weise an den Molekülen etwas Analoges wie die Noppen und zugehörigen Löcher, die wir von Legosteinen kennen: Ein so synthetisiertes Peptid-Molekül lagert sich am liebsten so mit anderen Peptiden zusammen, dass Noppen und Löcher aufeinandertreffen; nur dann entsteht eine neue stabile Struktur. Auf diesem Weg lassen sich lange Fasern herstellen, die in ihrer mikroskopischen Struktur zwar anders aufgebaut sind, jedoch von ihren räumlichen Maßen und ihrer chemischen Zusammensetzung den Fasern der körpereigenen extrazellulären Matrix sehr ähnlich sind.
Vom Reagenzglas zur Maus
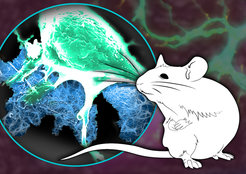
Wie verhalten sich Nervenzellen nun, wenn sie auf dieser künstlich erzeugten extrazellulären Matrix wachsen sollen? Und wie verändern sich diese Wachstumseigenschaften, wenn die ursprünglich zur Herstellung der Matrix verwendeten Peptide chemisch verändert werden? Diese Fragen haben wir gemeinsam mit unserem Kooperationspartner Bernd Knöll, Professor am Institut für Physiologische Chemie der Universität Ulm, untersucht. Hierzu haben wir viele verschiedene Peptid-Strukturen hergestellt, auf Glassubstrate aufgebracht und hierauf Nervenzellen kultiviert. Während manche Faserstrukturen quasi kein Wachstum erlaubten, konnte man bei anderen nach kurzer Zeit einen deutlichen Einfluss auf Nervenzellen feststellen: Sie bildeten sogenannte Axonen aus – zylinderförmige Fortsätze, welche die Verbindung zu anderen Nervenzellen herstellen.
Diejenige Faserstruktur, die sich hierbei als am effizientesten erwies, wurde in eine chirurgisch erzeugte Nervenlücke an einem Gesichtsnerv einer Maus injiziert, der für die Bewegung der Schnurrhaare verantwortlich ist. Nach einer Heilungszeit von 18 Tagen konnte die Maus ihre Schnurrhaare bereits wieder bewegen: Die Nervenbahnen sind selbstständig wieder zusammengewachsen.
Gesundheitlich unbedenklich
Die verwendeten Peptide sind chemisch den natürlichen Proteinen, welche die extrazelluläre Matrix der Zelle bilden, sehr ähnlich. Dies ist besonders wichtig, denn schließlich soll die künstlich erzeugte Matrix nur für die begrenzte Zeit der Heilung im Körper verbleiben und dort mit der Zeit abgebaut werden.
Richtungsweisende Eigenschaften
Bisher lassen sich mit unserer künstlichen Matrix bereits erste Schädigungen an Nervenbahnen reparieren, wie das Laborexperiment mit einer Maus gezeigt hat. Bis zum Einsatz am Menschen werden noch weitere Optimierungen nötig sein, um das Nervenbahnwachstum noch effizienter zu gestalten. So wachsen Nervenzellen auf unserem Material noch nicht so gut wie in der natürlichen Matrix und zudem recht ungeordnet in alle Richtungen. Ziel für die Zukunft ist daher, in die künstliche Matrix noch sogenannte Wachstumsfaktoren einzubetten, um die Heilung weiter zu beschleunigen. Mit solchen Wachstumsfaktoren lässt sich gezielt beeinflussen, in welche Richtung die Nervenzellen schließlich wachsen.
Wir sind zuversichtlich, dass in Zukunft für kleine Verletzungen an Nervenbahnen unsere künstliche extrazelluläre Matrix eine gute Alternative zu aufwändigen Operationen darstellen könnte – und gegebenenfalls, nach weiterer Forschung, man nicht nur Verletzungen am peripheren Nervensystem, sondern ebenfalls am zentralen Nervensystem behandeln kann.

